Bislang gibt es keine spezifische Therapie gegen Blauzapfenmonochromasie, aber die in neuerer Zeit erzielten gentherapeutischen Fortschritte bei einigen Netzhauterkrankungen (Lebersche kongenitale Amaurose und Chorioideremie) geben Anlass zur Hoffnung auf einen derartigen Ansatz auch bei Blauzapfenmonochromasie.
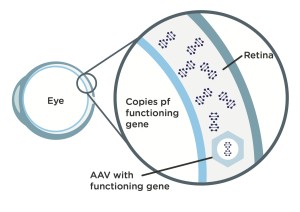
Bei einer Gentherapie wird ein zur Replikation unfähiges (also unschädliches) Virus, das als Vektor dient, in die Netzhaut injiziert, um ein spezifisches Gen in die Zellen des Patienten einzuschleusen. Das injizierte Virus infiziert die Zapfen, indem es dort die richtige genetische Sequenz einfügt, also jene, die sich in einem gesunden Menschen befindet. Diese Sequenz ersetzt nicht die mutierte Kopie des Gens im Kern der Zapfen des Erkrankten, sondern führt das fehlende Protein in das äußere Segment der Zapfen ein, um den Defekt zu korrigieren.
Schritt 1: Wissenschaftler modifizieren ein Adeno-assoziiertes Virus (AAV) – ein häufiges Virus, von dem nicht bekannt ist, dass es beim Menschen Krankheiten verursacht -, indem sie das, was sich im Inneren des Virus befindet, herausnehmen und durch eine funktionierende Kopie eines L-Opsin- oder M-Opsin-Gens ersetzen.
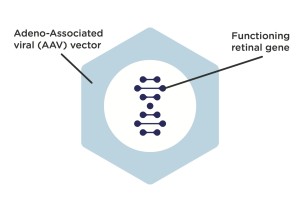
Schritt 2: Wenn Ärzte den modifizierten (AAV) Vektor in das Auge eines Patienten intravitreal injizieren, wandert er in die Netzhautzapfenzellen des Patienten. Im Inneren der Zapfen gibt der Vektor die funktionierende Kopie des L-Opsin- oder M-Opsin-Gens weiter, das der BCM-Patient benötigt und das im AAV-Vektor enthalten war.
Die mit der Gentherapie vorgenommene Korrektur wird nicht auf die nachfolgenden Generationen weitervererbt, weshalb diese sich ebenfalls einer solchen Behandlung unterziehen müssen.
Bei Leberscher kongenitaler Amaurose und Chorioideremie wurden nach Laborstudien und nachgewiesener Wirksamkeit im Tiermodell klinische Versuche eingeleitet, bei denen zahlreiche Patienten aus mehreren Ländern erfolgreich behandelt wurden.
Wissenschaftler entwickelten ein Tiermodell für die Blauzapfenmonochromie und untersuchten die Gentherapie anhand dieses Modells.
Weiterführende Informationen zum Thema Gentherapie und AAV-Virus finden Sie auf dieser Website.
Ein Tiermodell für Blauzapfenmonochromasie
Die BCM Families Foundation hat ein neues Tiermodell entwickelt, die BCM C198R-Maus. Diese Mauslinie wurde mit der CRISPR-Technologie erstellt, die zur präzisen Replikation der Punktmutation von Cystein-203 zu Arginin (C203R) verwendet wurde, die in den menschlichen LWS/MWS-Kegel-Opsin-Genen gefunden wurde. Der Unterschied in der Nummerierung 198 gegenüber 203 spiegelt die unterschiedliche Länge der Maus- und menschlichen Proteine wider. Diese Aminosäuresubstitutionsmutation ist bei etwa der Hälfte der Menschen mit dieser Krankheit weltweit für Blauzapfen-Monochromasie verantwortlich. Die BCM C198R-Mauslinie ist das erste Tiermodell, das zur Untersuchung der spezifischen pathogenetischen Mechanismen im Zusammenhang mit Blauzapfen-Monochromasie und zur Erprobung potenzieller Therapieansätze verfügbar ist. Seit September 2018 sind C198R-Mäuse im Jackson Laboratory erhältlich (Teilenummer 031385). Weitere Informationen zur BCMFF-C198R-Maus finden Sie hier BCMFF-C198R oder fordern Sie weitere Informationen per E-Mail an: info@BCMFamilies.org. Hier finden Sie einige Forschungsartikel zur Gentherapie an einem Tiermodell mit BCM
In der wissenschaftlichen Literatur finden sich zahlreiche Artikel zum Tiermodell mit einer Blauzapfenmonochromasie ähnlichen Erkrankung:
Deng WT, Li J, Zhu P, Freedman B, Smith W C, Baehr W, Hauswirth W W. ‚Rescue of M-cone Function in Aged Opn1mw−/− Mice, a Model for Late-Stage Blue Cone Monochromacy‘. Investigative Ophthalmology & Visual Science August (2019) Vol.60, 3644-3651. PMID: 31469404.
Deng WT, Li J, Zhu P, Chiodo V A, Smith W C, Freedman B, Baehr W, Pang J, Hauswirth W W. ‚Human L- and M-opsins restore M-cone function in a mouse model for human blue cone monochromacy‘. Molecular Vision (2018) 24, 17-28. PMID: 29386880.
Zhang Y, Deng WT, Du W, Zhu P, Li J, Xu F, Sun J, Gerstner C D, Baehr W, Boye Sanford L, Zhao C, Hauswirth W W, Pang J. ‚Gene-based Therapy in a Mouse Model of Blue Cone Monochromacy‘. Scientific Reports. 2017 7 (6690). PMID: 28751656.
Xie B, Nakanishi S, Guo Q, Xia F, Yan G, An J, Li L, Serikawa T, Kuramoto T, Zhang Z. ‚A novel middle-wavelength opsin (M-opsin) null-mutation in the retinal cone dysfunction rat‘. Exp. Eye Res. (2010) 91 (1):26-33. PMID: 20371244.
Zhang Z, Pang J, Xia F, Guo Q, Li L, An J, Zhang L, Hauswirth W W, Yang S, Li Z. ‚AAV-mediated Gene Therapy Restores Cone Function In A Rat With An M-cone Opsin Deficiency. A Model For Blue Cone Monochromacy‘. ARVO Annual Meeting Abstract 2011.
Nachstehend sind einige Artikel über die Ergebnisse der gentherapeutischen Behandlung von Daltonismus bei Primaten aufgeführt:
Mancuso K, Hauswirth W W, Li Q, Connor T B, Kuchenbecker J A, Mauck M C, Neitz J, Neitz M, ‚Gene therapy for red-green colour blindness in adult primates‘. Nature (2009);461:784-787. PMID: 19759534.
Mancuso K, Mauck M C, Kuchenbecker J A, Neitz M, and Neitz J. ‚A Multi-Stage Color Model Revisited: Implications for a Gene Therapy Cure for Red-Green Colorblindness‘. (2010) R.E. Anderson et al. (eds.), Retinal Degenerative Diseases, Advances in Experimental Medicine and Biology 664. PMID: 20238067.