El monocromatismo de conos azules (MCA) es un trastorno retiniano genético poco frecuente que se estima que afecta a 1 de cada 100 000 personas. Se trata de una degeneración retiniana hereditaria (DRH) causada por mutaciones en el grupo de genes OPN1LW/OPN1MW, que codifican opsinas sensibles a longitudes de onda largas (L) y medias (M) (es decir, rojo-verde) [38,39,41] de las células fotorreceptoras cónicas de la retina. Las discapacidades visuales son graves e incluyen una agudeza visual reducida, visión cromática anómala, miopía, nistagmo y fotofobia [11,20,21,34,52].
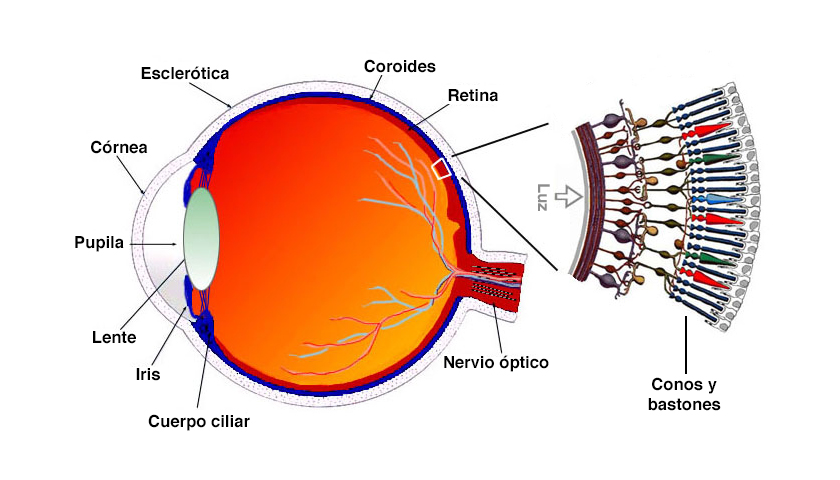
El monocromatismo de conos azules afecta a la retina, en la parte posterior del ojo.
Es una enfermedad recesiva ligada al cromosoma X, por lo que afecta casi exclusivamente a hombres (XY), mientras que las mujeres portadoras (XX) solo en pocas ocasiones muestran algunos de los síntomas de forma leve.
El monocromatismo de conos azules generalmente se considera una enfermedad estacionaria, cuyos síntomas se manifiestan por primera vez en la primera infancia, aunque hay evidencia de progresión de la enfermedad con cambios maculares asociados con la degeneración macular en muchos pacientes [5,6,34,52]. El primer síntoma observado es el nistagmo en recién nacidos de 2 a 3 meses.
Vídeo de un bebé de 4 meses con monocromatismo de conos azules que presenta nistagmo.
Síntomas
Hay tres tipos de conos en la retina humana que son responsables de la visión diurna, la agudeza visual y la visión cromática: son sensibles a la luz de longitud de onda larga (roja), media (verde) y corta (azul) [41]. Cuando las personas padecen monocromatismo de conos azules, tanto el cono rojo como el verde no funcionan correctamente, mientras que los conos azules funcionan con normalidad [5,38,39]. Los signos y síntomas pueden incluir una agudeza visual baja (claridad o nitidez), problemas en la visión cromática, fotofobia (sensibilidad a la luz), miopía y nistagmo (movimientos rápidos e incontrolables del ojo).
El monocromatismo de conos azules se caracteriza por una variedad de síntomas:
- agudeza visual baja que oscila entre 20/60 y 20/200;
- disminución de la discriminación cromática (disminución de la capacidad o incapacidad para distinguir los colores);
- intolerancia a la luz (caracterizada por la dificultad para ver con luz brillante, especialmente durante el día) y fotofobia asociada (sensibilidad a la luz);
- miopía, los pacientes suelen tener miopía;
- nistagmo (caracterizado por movimientos oculares rítmicos e involuntarios) que está presente desde los 2 meses de edad y puede disminuir lentamente con la edad.
En la mayoría de pacientes con monocromatismo de conos azules, los síntomas suelen ser estacionarios. Sin embargo, los estudios clínicos muestran evidencia de progresión de la enfermedad con cambios maculares [6,34,52].

Un niño con baja visión, sosteniendo el libro muy cerca.
Sinónimos:
- monocromía de conos azules;
- monocromía de conos S;
- acromatopsia atípica ligada al cromosoma X;
- acromatopsia incompleta ligada al cromosoma X.
Causas: genes y mutaciones
Hay tres genes implicados en el monocromatismo de conos azules y se encuentran en la posición Xq28, al final del brazo q del cromosoma X. Los tres genes van en tándem y son:
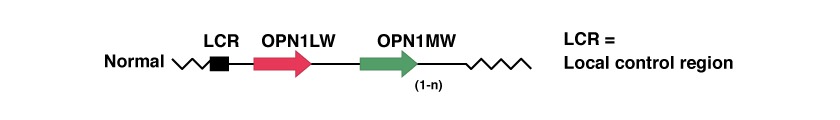
Estos genes codifican las proteínas que se necesitan en el proceso de convertir la luz en señales eléctricas que el cerebro utiliza para el procesamiento visual. Las proteínas se denominan opsinas de conos L y M, los cuales desempeñan un papel crucial en este proceso.
La región de control del locus (LCR) actúa como promotora para la expresión de los dos genes posteriores, el OPN1LW y el OPN1MW, que codifican las proteínas opsinas responsables de la captura de luz roja y verde en la retina humana. La LCR asegura la expresión exclusiva de un gen de opsina en cada cono [49,54,55].
Hay muchas mutaciones genéticas que pueden afectar a este grupo de genes y provocar el MCA [9,17,25,26,28,38,39]: una supresión de la LCR, una supresión intragénica de los exones dentro de los genes OPN1LW y OPN1MW y un mecanismo de 2 pasos con una recombinación homóloga y una inactivación puntual.
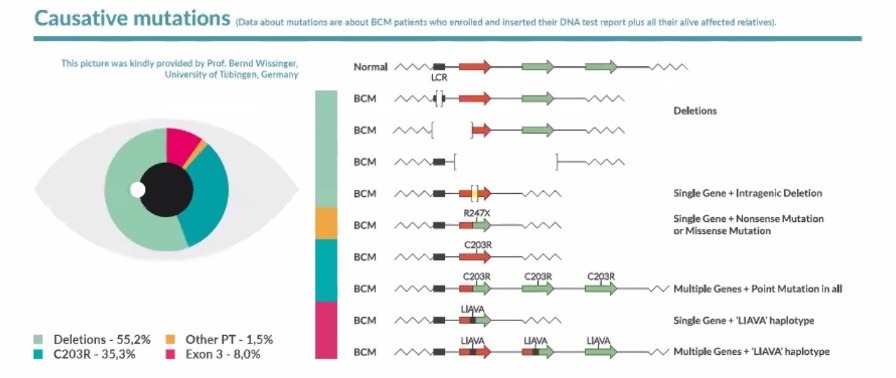
Imagen tomada de los datos agregados del registro de pacientes con MCA – BCMRegistry-Poster-2022-Final – [1]. El registro de pacientes con MCA se encuentra en www.BCMRegistry.org

Podemos ayudarte a entender mejor.
No dudes en escribirnos o unirte a nuestra comunidad online.
¿Cómo se transmite?
El monocromatismo de conos azules se transmite genéticamente a través de genes que se pasan de padres a hijos.
En particular, el monocromatismo de conos azules es una enfermedad recesiva ligada al cromosoma X, lo que significa que la enfermedad se expresa en hombres (XY) hemicigotos para la mutación y en las pocas mujeres (XX) que son homocigotas para la mutación genética, es decir, en mujeres que tengan la mutación genética en ambos cromosomas X. Por lo tanto, no es imposible que una mujer (XX) padezca MCA, pero es una afección extremadamente rara.
Diagnóstico
En un niño varón, a partir de los 2 meses, la aversión a la luz y al nistagmo pueden hacer sospechar de un caso de monocromatismo de conos azules, pero no proporciona indicios suficientes para establecer la forma de la afección. Para identificar un caso de monocromatismo de conos azules, es necesario reconstruir los antecedentes familiares, con la afección vinculada a la transmisión del cromosoma X, si hay otros casos en la familia. En personas adultas, se pueden evaluar la agudeza visual y la visión cromática y se puede hacer un diagnóstico clínico. Sin embargo, el paso más importante es la confirmación genética mediante una prueba de ADN.
Las herramientas de diagnóstico más adecuadas son:
- una prueba de ADN;
- una prueba de color como la Farnsworth D-15 o la prueba Farnsworth Munsell 100 Hue;
- la reconstrucción de los antecedentes familiares o del árbol genealógico familiar de la enfermedad;
- el electrorretinograma (ERG), que puede demostrar la pérdida de las funciones de los conos L/M con el consiguiente mantenimiento de la función de los bastones y conos S [4].
Es importante considerar el diagnóstico diferencial para distinguir el monocromatismo de conos azules de otras enfermedades que presenten características clínicas similares, por ejemplo, la acromatopsia [7]. Es importante llegar al diagnóstico correcto porque la evolución de la enfermedad, los posibles tratamientos y las ayudas necesarias cambian según la afección específica. El paso crucial para confirmar el diagnóstico del monocromatismo de conos azules es la prueba de ADN.
Tratamientos y terapia génica
Hasta el momento, no existe una cura conocida para el monocromatismo de conos azules; sin embargo, actualmente se está evaluando la eficacia y la seguridad de varios tratamientos prospectivos, donde el tratamiento génico es el más prometedor.
El objetivo de los estudios de terapia génica [15,16,23,51,59,61,62] es complementar de forma viral las células retinianas que expresan genes mutantes asociados con el fenotipo de monocromatismo de conos azules con formas sanas del gen y, de este modo, permitir la reparación y el funcionamiento adecuado de las células fotorreceptoras de la retina en respuesta a las instrucciones asociadas con el gen sano insertado.
Además, las ayudas visuales correctivas y el tratamiento visual personalizado que brindan los especialistas en visión parcial pueden ayudar a los pacientes a corregir el deslumbramiento y optimizar su agudeza visual.
Epidemiología
El monocromatismo de conos azules es una causa de visión parcial hereditaria que se estima que afecta aproximadamente a 1 de cada 100 000 personas [27]. La enfermedad afecta a los varones receptores de la mutación ligada al cromosoma X, mientras que las mujeres suelen seguir siendo portadoras no afectadas del MCA.
Consideraciones históricas
Primeros descubrimientos
El monocromatismo de conos azules se conoce desde hace muchos años, y la primera descripción detallada se remonta a Huddart en 1777 [24], quien reconoció que las personas afectadas por esta afección tenían dificultades para distinguir los colores, pero podían diferenciar entre el blanco, el negro y varios colores claros o brillantes.
Sloan llevó a cabo estudios posteriores sobre el monocromatismo de conos azules en 1954 [48] y Blackwell y Blackwell en 1961 [8], quienes describieron a pacientes capaces de distinguir entre señales azules y amarillas que parecían tener conos S y bastones funcionales. Además, Spivey en 1965 [50] indicó que las personas afectadas podían ver pequeños objetos azules en un gran campo amarillo y viceversa.
La enfermedad también ha sido estudiada por Alpern et al. (1960) [2,3] y por Fleischman (1981), pero los resultados más importantes los obtuvieron en 1989 y 1993 Nathans et al. [38,39] y en 1991 Reyniers et al. [46], quienes identificaron los genes que causan este monocromatismo.
Estudios recientes
Solo en los últimos años y gracias al apoyo de la BCM Families Foundation se ha estudiado el monocromatismo de conos azules con el objetivo de encontrar un tratamiento.
En concreto, desde 2010, la BCM Families Foundation ha estado financiando estudios clínicos en la Universidad de Pensilvania con el objetivo de entender si la genoterapia puede ser un tratamiento para el monocromatismo de conos azules. Los resultados positivos, nunca antes obtenidos, muestran la presencia de suficientes conos en la retina como para justificar el tratamiento génico [11]. Estos conos fotorreceptores se pueden tratar con genoterapia. En otro estudio se compararon a pacientes que pertenecían a las dos principales mutaciones causantes del monocromatismo de conos azules, las supresiones y las mutaciones de sentido alterado de C203R, e identificó las ventanas de oportunidad de la edad para intervenir mediante el tratamiento génico [52]. Este conjunto de estudios representa un estudio de evolución natural del monocromatismo de conos azules. Otros estudios han llevado a la identificación de los criterios de valoración de un ensayo clínico y a la identificación de los criterios de inclusión y exclusión [12,30,33,47,51].
Gracias al apoyo financiero y la colaboración de la BCM Families Foundation, se han realizado varios estudios sobre vectores de tratamiento génico. El grupo del Dr. W.W. Hauswirth, de la Universidad de Florida, primero, y el grupo del Dr. Wen Tao Deng de la Universidad de West Virginia, posteriormente, han estado trabajando en modelos animales de monocromatismo de conos azules para identificar el mejor vector VAA para el tratamiento génico [15,16,18,23,59,61,62]. Adverum Biotechnologies, Inc. ha evaluado un nuevo vector de tratamiento génico intravítreo para el tratamiento del monocromatismo de conos azules [23]. Utilizó ADVM-062, un vector optimizado para la expresión de opsina L humana en conos específicos. A diferencia de los tratamientos existentes que implican la inyección de vectores subretinianos, el ADVM-062 se puede administrar mediante una sola inyección intravítrea (TIV), lo que representa un menor riesgo para la estructura retiniana central de los pacientes con MCA.
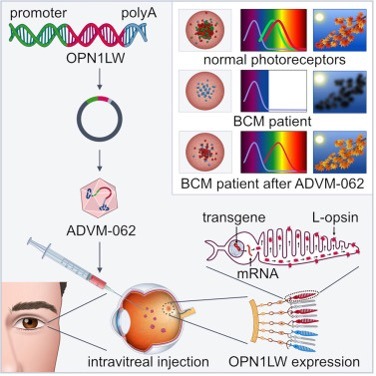
Picture taken from ref. [23]
Se han realizado varios estudios científicos recientes sobre el monocromatismo de conos azules [9,17,25,26,28,38,39,46,58] para identificar todas las mutaciones causantes y comprender en profundidad las principales. Las tecnologías de secuenciación de ADN de nueva generación (NGS, por sus siglas en inglés) se han introducido en los laboratorios y permiten secuenciar todo el exoma o todo el genoma. Estas tecnologías representan el futuro de las pruebas de ADN, ya que ofrecen la posibilidad de secuenciar un exoma o genoma completo en cuestión de días a un coste razonable y permiten detectar enfermedades genéticas que de otro modo pasarían desapercibidas. Sin embargo, la secuenciación de nueva generación de lectura corta, ampliamente utilizada, no es apropiada para el análisis del grupo de genes OPN1LW/OPN1MW del monocromatismo de conos azules, y recientemente se ha desarrollado una nueva herramienta [22].
Videos
- Vídeo de los centros de baja visión de Indiana (Low Vision Centers of Indiana) que muestra los síntomas del monocromatismo de conos azules y el uso de lentes de contacto con filtro magenta:
- Vídeo de un bebé de 4 meses con monocromatismo de conos azules que presenta nistagmo:
Recursos externos:
- The BCM Patient Registry
- OMIM page for Blue Cone Monochromacy – Online Mendelian Inheritance in Man (OMIM) is an online catalog of human genes and genetic disorders developed and maintained by the McKusick-Nathans Institute of Genetic Medicine at Johns Hopkins University.
- Orphanet – Orphanet is a European database and web portal that provides information about rare diseases to promote research and collaboration in the field.
- University of Tübingen, Germany project on Blue Cone Monochromacy
- A Colorful Cure: How Gene Therapy Is Treating Blue Cone Monochromacy (Forbes, 2023)
- Achromatopsia.info – Journey through the Light
- Kohl, S., Hamel, C. Clinical utility gene card for: blue cone monochromatism. Eur J Hum Genet19, 732 (2011)
- National Center for Advancing Translational Sciences
- The University of Arizona Health Sciences’ page for Blue Cone Monochromacy
- Fighting Blindness’ page for Blue Cone Monochromacy
Referencias:
- “Patient Registry – Blue Cone Monochromacy”.
- Alpern M, Lee G B, Maaseidvaag F, Miller SS, (1971). “Colour vision in blue cone ‘monochromacy’”. Physiol. 212 (1): 211–33. doi:10.1113/jphysiol.1971.sp009318.
- Alpern M, Falls H F, Lee G B, (1960). “The enigma of typical total monochromacy”. Am. J. Ophthalmol. 50 (5): 996–1012. doi:1016/0002-9394(60)90353-6. PMID13682677.
- Andréasson, S; Tornqvist, K (1991). “Electroretinograms in patients with achromatopsia”. Acta Ophthal. (Copenh) 69 (6): 711-716. PMID 1789084. https://doi.org/10.1111/j.1755-3768.1991.tb02048.x
- Ayyagari R, Kakuk L E, Bingham E L, Szczesny J J, Kemp J, Toda Y, Felius J, Sieving P A, (2000). “Spectrum of color gene deletions and phenotype in patients with blue cone monochromacy” Genet. 107 (1): 75–82. doi:10.1007/s004390000338.
- Ayyagari R, Kakuk L E, Coats C L, Bingham EL, Toda Y, Felius J, Sieving P A, (1999).”Bilateral macular atrophy in blue cone monochromacy (BCM) with loss of the locus control region (LCR) and part of the red pigment gene”. Mol. Vis. 28: 5-13. PMID 10427103.
- Berson EL, Sandberg MA, Rosner B, Sullivan PL, (1983). “Color plates to help identify patients with blue cone monochromatism”. Am. J. Ophthalmol. 95 (6): 741–7. doi:1016/0002-9394(83)90058-2. PMID6602551.
- Blackwell H R, Blackwell O M, (1961). “Rod and cone receptor mechanisms in typical and atypical congenital achromatopsia”. Vision Res. 1 (1–2): 62–107. doi:1016/0042-6989(61)90022-0.
- Buena-Atienza E, Nasser F, Kohl S, Wissinger B, (2018) “A 73,128 bp de novo deletion encompassing the OPN1LW/OPN1MW gene cluster in sporadic Blue Cone Monochromacy: A case report.” BMC Med. Genet. 19, 107 (2018). – DOI: 1186/s12881-018-0623-8
- Carroll J, et al. (2010) “Deletion of the X-linked opsin gene array locus control region (LCR) results in disruption of the cone mosaic” Vision Res. 50, 1989–1999 (2010). – doi: 1016/j.visres.2010.07.009
- Cideciyan A V, Hufnagel R B, Carroll J, Sumaroka A, Luo X, Schwartz S B, Dubra A, Land M, Michaelides M, Gardner J C, Hardcastle A J, Moore A T, Sisk R A, Ahmed Z M, Kohl S, Wissinger B, Jacobson S G, (2013) “Human cone visual pigment deletions spare sufficient photoreceptors to warrant gene therapy”. Hum Gene Ther 2013; 24: 993-1006. – DOI: 1089/hum.2013.153
- Cideciyan A V, Roman A J, Jacobson S G, Yan B, Pascolini M, Charng J, Pajaro S, Nirenberg S, (2016) “Developing an outcome measure with high luminance for optogenetics treatment of severe retinal degenerations and for gene therapy of cone diseases”. Invest Ophthalmol Vis Sci. 57(7):3211-21. DOI: 1167/iovs.16-19586
- Crognale M A, Fry M, Highsmith J, Haegerstrom-Portnoy G, Neitz M, Neitz J, Webster M A, (2004). “Characterization of a novel form of X-linked incomplete achromatopsia”. Neurosci. 21 (3): 197-203. DOI: 10.1017/s0952523804213384
- Deeb S S, (2005). “The molecular basis of variation in human color vision”. Genet. 67 (5): 369-377. DOI: 10.1111/j.1399-0004.2004.00343.x
- Deng WT, Li J, Zhu P, Chiodo V A, Smith W C, Freedman B, Baehr W, Pang J, Hauswirth W W. (2018) ‘Human L- and M-opsins restore M-cone function in a mouse model for human blue cone monochromacy’. Molecular Vision (2018) 24, 17-28. PMID: 29386880.
- Deng WT, Li J, Zhu P, Freedman B, Smith W C, Baehr W, Hauswirth W W, (2019) “Rescue of M-cone Function in Aged Opn1mw−/− Mice, a Model for Late-Stage Blue Cone Monochromacy”. Investigative Ophthalmology & Visual Science August (2019) Vol.60, 3644-3651. PMID: 31469404.
- Buena-Atienza E, Rüther K, Baumann B et al. (2016) “De novo intrachromosomal gene conversion from OPN1MW to OPN1LW in the male germline results in Blue Cone Monochromacy”. Sci Rep 6, 28253 (2016). DOI: 10.1038/srep28253.
- Emily R. Sechrest, Kathryn Chmelik, Wendy D. Tan, Wen-Tao Deng, (2023) “Blue cone monochromacy and gene therapy” Vision Research,Volume 208,2023,108221,ISSN 0042-6989, – DOI: 1016/j.visres.2023.108221
- Gardner J C, Liew G, Quan Y H, Ermetal B, Ueyama H, Davidson A E, Schwarz N, Kanuga N, Chana R, Maher E, Webster A R, Holder G E, Robson A G, Cheetham, M E, Liebelt J, Ruddle J B, Moore A T, Michaelides M, Hardcastle A J, (2014). “A three different cone opsin gene array mutational mechanisms with genotype-phenotype correlation and functional investigation of cone opsin variants”. Mutat. 35 (11): 1354-1362. DOI: 10.1002/humu.22679
- Gardner J C, Webb T R, Kanuga N, Robson A G, Holder G E, Stockman A, Ripamonti C, Ebenezer N D, Ogun O, Devery S, Wright G A, Maher E R, Cheetham M E, Moore A T, Michaelides M, Hardcastle A J, (2010). “X-Linked Cone Dystrophy Caused by Mutation of the Red and Green Cone Opsins”. J. Hum. Genet. 87 (1): 26–39. doi:10.1016/j.ajhg.2010.05.019.
- Gardner J C, Michaelides M, Holder G E, Kanuga N, Webb T R, Mollon J D, Moore A T, Hardcastle A J, (2009). “Blue cone monochromacy: Causative mutations and associated phenotypes”. Molecular Vision. 15: 876–884. PMC2676201. PMID 19421413.
- Haer-Wigman L, den Ouden A, van Genderen MM, Kroes HY, Verheij J, Smailhodzic D, Hoekstra AS, Vijzelaar R, Blom J, Derks R, Tjon-Pon-Fong M, Yntema HG, Nelen MR, Vissers LELM, Lugtenberg D, Neveling K. (2022) “Diagnostic analysis of the highly complex OPN1LW/OPN1MW gene cluster using long-read sequencing and MLPA.” NPJ Genom Med. 2022 Nov 9;7(1):65. doi: 10.1038/s41525-022-00334-9.
- Hanna K, Nieves J, Dowd C, Bender K O, Sharma P, Singh B, Renz M, Ver Hoeve J N, Cepeda D, Gelfman C M, Riley B E, Grishanin R N, (2023) “Preclinical evaluation of ADVM-062, a novel intravitreal gene therapy vector for the treatment of blue cone monochromacy”. Mol Ther. 2023 Jul 5;31(7):2014-2027. doi: 10.1016/j.ymthe.2023.03.011.
- Huddart, J (1777). “An account of persons who could not distinguish colours”. Philos. Trans. R. Soc. 67: 260. doi:1098/rstl.1777.0015. S2CID186212155.
- Katagiri S., et al. , (2018) “Genotype determination of the OPN1LW/OPN1MW genes: Novel disease-causing mechanisms in Japanese patients with blue cone monochromacy”. Sci. Rep. 8, 11507 (2018). DOI: 1038/s41598-018-29891-9
- Keller U, Wissinger B, Tippmann S, Kohl S, Kraus H, Foerster M H, (2004). “Blue cone monochromatism: clinical findings in patients with mutations in the red/green opsin gene cluster”. Graefes Arch. Clin. Exp. Ophthalmol. 242 (9): 729-735. DOI: 1007/s00417-004-0921-z .
- Kohl S, Hamel C P, (2011). “Clinical utility gene card for: blue cone monochromatism”. Eur. J. Hum. Genet. 19 (6): 732. doi:1038/ejhg.2010.232.
- Ladekjaer-Mikkelsen, A S; Rosenberg, T; Jørgensen, A L (1996). “A new mechanism in blue cone monochromatism”. Hum. Genet. 98 (4): 403–408. doi:1007/s004390050229.
- Lewis R A, Holcomb J D, Bromley W C, Wilson M C, Roderick T H, Hejtmancik J F, (1987). “Mapping X-linked ophthalmic diseases: III. Provisional assignment of the locus for blue cone monochromacy to Xq28”. Arch. Ophthalmol. 105 (8): 1055-1059. DOI: 1001/archopht.1987.01060080057028
- Luo X, Cideciyan A V, Iannaccone A, Roman A J, Ditta L C, Jennings B J, Yatsenko S, Sheplock R, Sumaroka A, Swider M, Schwartz S B, Wissinger B, Kohl S, Jacobson S G, (2015). “Blue cone monochromacy: visual function and efficacy outcome measures for clinical trials”. PLOS ONE. 10 (4): e0125700 doi:1371/journal.pone.0125700.
- Mancuso K, Hauswirth W W, Li Q, Connor T B, Kuchenbecker J A, Mauck M C, Neitz J, Neitz M, (2009) “Gene therapy for red-green colour blindness in adult primates”. Nature (2009) 461:784-787. PMID: 19759534.
- Mancuso K, Mauck M C, Kuchenbecker J A, Neitz M, and Neitz J, (2010) “A Multi-Stage Color Model Revisited: Implications for a Gene Therapy Cure for Red-Green Colorblindness’2 (2010) R.E. Anderson et al. (eds.), Retinal Degenerative Diseases, Advances in Experimental Medicine and Biology 664. PMID: 20238067.
- Mascio A A, Roman A J, Cideciyan A V, Sheplock R, Wu V, Garafalo A V, Sumaroka A, Pirkle S, Kohl S, Wissinger B, Jacobson S G and Barbur J L, (2023) “Color vision in blue cone monochromacy: outcome measures for a clinical trial” Transl Vis Sci Techno 2023 Jan 3;12(1):25 DOI: 1167/tvst.12.1.25
- Michaelides M, Johnson S, Simunovic M P, Bradshaw K, Holder G, Mollon J D, Moore A T, Hunt D M, (2005). “Blue cone monochromatism: a phenotype and genotype assessment with evidence of progressive loss of cone function in older individuals”. Eye (Lond). 19 (1): 2–10. doi:1038/sj.eye.6701391. PMID15094734.
- Mizrahi-Meissonnier L, Merin S, Banin E, Sharon D, (2010). “Variable Retinal Phenotypes caused by mutations in the X-linked phopigment gene array”. Inv. Ophthal. Vis. Sci. 51 (8): 3884-92. PMID 20220053.
- Nathans, J (1987). “Molecular biology of visual pigments”. Rev. Neurosci 10: 163-194. PMID 3551758.
- Nathans, J (1999). “The evolution and physiology of human color vision: insights from molecular genetic studies of visual pigments”. 24 (2): 299-312. PMID 10571225
- Nathans, J; Davenport, C M; Maumenee, I H; Lewis, R A; Hejtmancik, J F; Litt, M; Lovrien, E; Weleber, R; Bachynski, B; Zwas, F; Klingaman, R; Fishman, G (1989). “Molecular genetics of human blue cone monochromacy”. Science. 245 (4920): 831–838. doi:1126/science.2788922.
- Nathans J, Maumenee I H, Zrenner E, Sadowski B, Sharpe L T, Lewis R A, Hansen E, Rosenberg T, Schwartz M, Heckenlively J R, Trabulsi E, Klingaman R, Bech-Hansen N T, LaRoche G R, Pagon R A, Murphey W H, Weleber R G, (1993). “Genetic heterogeneity among blue cone monochromats”. J. Hum. Genet. 53 (5): 987–1000. PMC1682301. PMID 8213841.
- Nathans J, Piantanida T P, Eddy R L, Shows T B, Hogness D S, (1986). “Molecular genetics of inherited variation in human color vision”. Science 232 (4747): 203-210. PMID 3485310.
- Nathans J, Thomas D, Hogness D S, (1986). “Molecular genetics of human color vision: the genes encoding blue, green, and red pigments”. Science 232 (4747): 193-202. PMID 2937147
- Neitz J, Neitz M, (2011). “The genetics of normal and defective color vision”. Vision Res. 51 (7): 633–651. doi:1016/j.visres.2010.12.002.
- Neitz M, (2000). “Molecular Genetics of Color Vision and Color Vision Defects”. Archives of Ophthalmology. 118 (5): 691–700. doi:1001/archopht.118.5.691.
- Pinckers A, (1992) “Berson test for blue cone monochromatism”. Int. Ophthalmol. 16 (3):185-186. PMID 1452423.
- Reitner A, Sharpe L T, Zrenner E, (1991). “Is colour vision possible with only rods and Blue sensitive cones?”. Nature. 352 (6338): 798–800. Bibcode:352..798R. doi:10.1038/352798a0. PMID1881435. S2CID 4328439
- Reyniers E, et al. , (1995) “Gene conversion between red and defective green opsin gene in blue cone monochromacy”. Genomics 29, 323–328 (1995). – PubMed
- Semenov E P, Sheplock R, Roman A J, McGuigan D B, Swider M, Cideciyan A V, Jacobson S G, (2022) “Reading performance in blue cone monochromacy: defining an outcome measure for a clinical trial.” Transl Vis Sci Technol. 2020 Dec 8;9(13):13. – doi: 1167/tvst.9.13.13
- Sloan L L, Newhall S M, (1942). “Comparison of cases of atypical and typical achromatopsia”. American Journal of Ophthalmology. 25 (8): 945–961. doi:1016/S0002-9394(42)90594-4.
- Smallwood P M, Wang Y, Nathans J, (2002) “Role of a locus control region in the mutually exclusive expression of human red and green cone pigment genes”. Proc. Natl. Acad. Sci. U.S.A. 99, 1008–1011 (2002). – PMC – PubMed
- Spivey B E, (1965) “The X-linked recessive inheritance of atypical monochromatism”. Arch. Ophthalmol. 74 (3): 327–333. doi:1001/archopht.1965.00970040329007.
- Sumaroka A, Cideciyan AV, Sheplock R, Wu V, Kohl S, Wissinger B, Jacobson SG, (2020) “Foveal therapy in blue cone monochromacy: predictions of visual potential from artificial intelligence”. Front Neurosci. 2020 Aug 3;14:800. doi: 10.3389/fnins.2020.00800.
- Sumaroka A, Garafalo AV, Cideciyan AV, Charng J, Roman AJ, Choi W, Saxena S, Aksianiuk V, Kohl S, Wissinger B, Jacobson SG. (2018) “Blue cone monochromacy caused by the C203R missense mutation or large deletion mutations”. Invest Ophthalmol Vis Sci. 2018 Dec 3;59(15):5762-72. doi:https://doi.org/10.1167/iovs.18-25280
- Wang C., et al. , Novel OPN1LW/OPN1MW deletion mutations in 2 Japanese families with blue cone monochromacy. Hum. Genome Var. 3, 16011 (2016). – PMC – PubMed
- Wang Y., et al. , A locus control region adjacent to the human red and green visual pigment genes. Neuron 9, 429–440 (1992). – PubMed
- Wang, Y; Macke, J P; Merbs, S L; Zack, D J; Klaunberg, B; Bennett, J; Gearhart, J; Nathans, J (1992). “A locus control region adjacent to the human red and green visual pigment genes”. 9 (3): 429-440. PMID 1524826.
- Weale, RA (1953). “Cone Monochromatism”. The Journal of Physiology. 121 (3): 548–569. doi:1113/jphysiol.1953.sp004964.
- Winderickx J, Sanocki E, Lindsey DT, Teller DY, Motulsky AG, Deeb SS, (1992). “Defective colour vision associated with a missense mutation in the human green visual pigment gene”. Nat. Genet. 1 (4): 251–6. doi:1038/ng0792-251.
- Wissinger B, Baumann B, Buena-Atienza E, Ravesh Z, Cideciyan AV, Stingl K, Audo I, Meunier I, Bocquet B, Traboulsi EI, Hardcastle AJ, Gardner JC, Michaelides M, Branham KE, Rosenberg T, Andreasson S, Dollfus H, Birch D, Vincent AL, Martorell L, Català Mora J, Kellner U, Rüther K, Lorenz B, Preising MN, Manfredini E, Zarate YA, Vijzelaar R, Zrenner E, Jacobson SG, Kohl S, (2022) “The landscape of submicroscopic structural variants at the OPN1LW/OPN1MW gene cluster on Xq28 underlying blue cone monochromacy”. Proc Natl Acad Sci U S A. 2022 Jul 5;119(27):e2115538119. doi: 10.1073/pnas.2115538119.
- Xie B, Nakanishi S, Guo Q, Xia F, Yan G, An J, Li L, Serikawa T, Kuramoto T, Zhang Z. (2010) ”A novel middle-wavelength opsin (M-opsin) null-mutation in the retinal cone dysfunction rat”. Exp. Eye Res. (2010) 91 (1):26-33. PMID: 20371244.
- Yatsenko S. A., et al. , “High-resolution microarray analysis unravels complex Xq28 aberrations in patients and carriers affected by X-linked blue cone monochromacy”. Clin. Genet. 89, 82–87 (2016). – PMC – PubMed
- Zhang Z, Pang J, Xia F, Guo Q, Li L, An J, Zhang L, Hauswirth W W, Yang S, Li Z. “AAV-mediated Gene Therapy Restores Cone Function In A Rat With An M-cone Opsin Deficiency. A Model For Blue Cone Monochromacy”. PMID: 29386880.
- Zhang Y, Deng W T, Du W, Zhu P, Li J, Xu F, Sun J, Gerstner C D, Baehr W, Boye Sanford L, Zhao C, Hauswirth W W, Pang J, (2017) “Gene-based Therapy in a Mouse Model of Blue Cone Monochromacy”. Sci Rep 7, 6690 (2017). https://doi.org/10.1038/s41598-017-06982-7


